使用方法
〈概略図〉
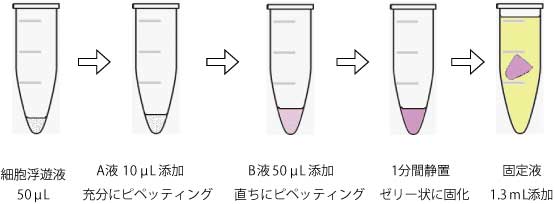
実験前に、練習として培地などを使い溶液が固まる速度を確認してください。
【培養細胞や血液細胞など分散している細胞の場合】
- 試薬(A-solution、B-solution)を解凍し、A-solution は氷上、B-solution は室温に保持 ※1
- 細胞浮遊液は遠心処理したのちに少量の培地 やバッファーなどで再懸濁し、氷上に保持 ※2,3
- サンプルチューブに、A-solution 10 µL と細胞懸濁液 50 µL を加えて十分にピペッティング
- 3のサンプルチューブにB-solution(赤色) 50 µLを加え、直ちに3回ピペッティング
- 数秒で固まり始めますので、ピペッティングは速やかに行ってください。
- 4回以上のピペッティングは避けてください。ピペッティングを繰り返しますと、サンプルがチップ内でゼリー状に固まり始めてしまいます。
- B液を入れた後はチューブを振ったり、タッピングやボルテックスなどで激しく撹拌しないでください。
- ピペッティング中に泡が出来てしまった場合は、泡を無理に消そうとせず、そのままにしてください。
- サンプルチューブを室温にて1分静置した後、チューブを逆さまにしてサンプルがゼリー状に固まったことを確認
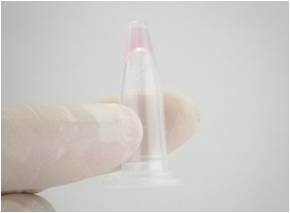
- 固定液 1.2 mLを 加え、サンプルがチューブから剥がれるように軽くピペッティング ※4

- 使用目的に適した固定を行い、組織ブロックを作製
※1. 試薬は37℃にて速やかに解凍して下さい。解凍後は十分に攪拌してください。
固定液を入れた際にゼリーが見やすくなるように、B-solutionはフェノールレッドで赤色に着色しています。
保存状態・細胞浮遊液のpHによって黄色に変化する場合がありますが、品質に問題はありません。
B-solutionに澱のようなものが残った場合は、軽く遠心し上清をご使用ください。
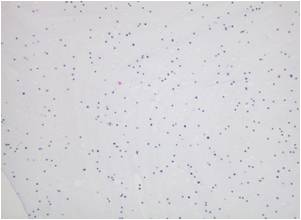
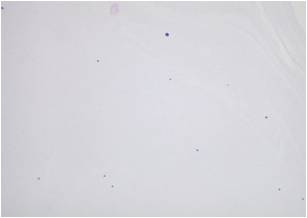
※2. 再懸濁する際の細胞濃度の目安は、図-1を参照してください。
細胞を再懸濁する際の溶液には、培地(血清を含んでいても問題ありません)や中性pH のバッファーが適しています。
※3. 固定済みの細胞を使用する場合、固定液が残っていると上手く固まらないことがあります。
軽い遠心などで固定液を除いた後、PBSで洗浄し、培地またはPBSなどに再懸濁してください。
またゼリー状に固めた後は、再度固定液に浸漬してください。
※4. 固定液は、ブロック作製後の使用目的(ISH、免疫組織化学染色など)に応じて適切なものをご用意ください。
ISHの場合は、弊社のISH用固定液(品番:STF-01)のご使用をお勧めいたします。
ゼリー状に固まったサンプルの赤色は、固定中に無色へと変化します。
本製品は、アセトン固定には適していません。
【微小組織や三次元培養細胞など細胞塊を維持するサンプル(例;胚様体)の場合】
サンプル溶液をピペッティングする際(工程3, 4)、組織構造・細胞塊の破壊を避けるために先端部をハサミ等で切り落として加工したチップをお使いください。

<図‐1 細胞濃度の目安>
(倍率x100)
 |
 |
![]()
- 一度解凍した試薬(A-solution、B-solution)は、保存することができません。
実験毎に新しいチューブの試薬をご使用ください。 - 試薬を取り扱う際には、必ず手袋を着用してください。
- 本製品は研究用です。 試験・研究用以外(医療品、食品、化粧品、家庭用品など)には使用しないでください。
iPGellで調製したサンプルをパラフィンブロックとして使用する場合
<パラフィンブロック作製手順>
- iPGellを使用して細胞懸濁液のゼリーを作製し、固定液に浸漬
- チューブを軽く振盪しながら、1晩~1日間固定
- PBSで洗浄 30分間
- 70%エタノールに置換 30分間×2回
- 定法に従い、パラフィン包埋(70%エタノール~)
- 70%エタノールに置換後、4℃にて2-3日間は保存が可能ですが、できるだけ早めにパラフィン包埋してください。
- パラフィン包埋後、ゼリーの大きさは7-8割に縮みます。
- 染色方法によっては切片上のゼリー部分に色がつく場合があります。
~パラフィン包埋の例 (ロータリー式自動包埋機を使用) ~
- 70%エタノール 室温 1時間
- 80%エタノール 室温 1時間
- 90%エタノール 室温 1時間
- 100%エタノール1 室温 1時間
- 100%エタノール2 室温 1時間
- 100%エタノール3 室温 1時間
- 100%エタノール/キシレン 1:1 室温 1時間
- キシレン1 室温 1時間
- キシレン2 室温 1時間
- キシレン3 室温 1時間
- パラフィン1 65℃ 1時間
- パラフィン2 65℃ 1時間
- パラフィン3 65℃ 1時間
パラフィンに包埋した際は以下のようになります。
![]()
iPGellで固めたサンプルをパラフィン包埋する際に、加圧や減圧を伴う包埋機をご使用されますと、組織が変形する可能性があります。ロータリー式の包埋機のご使用をお奨めいたします。
iPGellで調製したサンプルを既固定凍結ブロックとして使用する場合
<既固定凍結ブロック作製手順>
- iPGellを使用して細胞懸濁液のゼリーを作製(前ページ-使用方法参照)
- 4%PFA/PBSを添加して1時間~1晩固定※1
- PBSでリンスした後、新しいPBSに変えて30分間洗浄
- ゼリーをカセット等に移し、シュークロース置換 (4℃) ※2
①10%sucrose/PBS 2~4時間
②20%sucrose/PBS 2時間~1晩
③30%sucrose/PBS 2時間~1晩 - 置換完了後、キムタオル上でゼリーを転がし、周囲についた水分を軽く取り除く ※3
- コンパウンド中に軽くなじませ、そのまま15分間浸漬
- クライオモールドに新しいコンパウンドを入れ、6のゼリーを包埋
- ドライアイス・ヘキサンなどで急速凍結 ※4
※1. 免疫組織化学染色を目的とする場合は、ご使用の抗体に適した時間で固定してください。
固定中は振盪機などでチューブ内の固定液を緩やかに攪拌して下さい。
顆粒細胞を扱う場合、細胞が壊れやすいため固定を一晩行ってください。
※2. シュークロース置換は、ゼリーをチューブから取り出し容量の大きい別の容器に移して行ってください。
シュークロース中ではゼリーが沈みにくいため、カセットに入れる、もしくはキムワイプなどで押さえて、
サンプルを液中に沈めた状態で置換を行ってください

固定液が残存していると染色性に影響する可能性がありますので、シュークロース置換には十分な時間をとってください。
※3. ゼリーが乾燥しないように注意してください。
※4. 液体窒素を使用される場合は、サンプルにヒビが入りやすいのでご注意ください。
既固定凍結切片作製時のご注意
- 既固定凍結ブロックでは、ブロック中のゼリー(サンプル)が非常に見え難くなります。
- 薄切は-25℃前後から調整してください。温度が高いとゼリー部分がナイフについてしまい、切片にならない事があります。
- 切片のゼリー(サンプル)部分は非常に破れやすいため取り扱いにご注意ください。
- 切片作製には剥離防止処理済スライドガラスをご使用ください。
以下のスライドガラスのご使用をお勧めいたします。
*武藤化学 ポリ- L-リジンコート、マツナミガラス APSコートなど - 冷却したスライドガラスに切片を貼り付けると、ゼリー部分がスライド上で収縮する場合があります。収縮に伴い、微小組織や3次元培養細胞などでは組織が変形する可能性があります。
切片を貼り付ける際は常温のスライドガラスをご使用ください。 - スライドの種類、ロットによってはゼリー部分の収縮が大きいものもあります。
- 凍結ブロックは-80℃で保管してください。
80℃~-20℃間の温度変化を繰り返しますと、ブロックが劣化し薄切が出来なくなる可能性があります。
-80℃庫からの出し入れ、薄切は最小限にしてください。 - 染色法によっては切片上のゼリー部分に色がつく場合があります。
必要に応じて染色前にテストを行いご確認ください。
![]()
本製品は未固定凍結切片には適応しておりません


