2018年4月28日 更新
病院の病理検査室で診断目的で行う免疫染色やISH『臨床病理』と、マウスや動物を用いて研究目的で行う免疫染色やISH『分子病理』※では、根本的な考え方が違うと思っています。
※今回は、研究目的のISHや免疫染色を『分子病理』と呼ぶことにします。
私たちが感じている、この2つの違いをざっくり比較表に纏めました。
臨床病理 vs 分子病理
| 臨床病理 | 分子病理 | |
| 組織(検体) | ヒト | ヒト、マウス、ラット、サル、魚類、植物 等 生物全て |
| 抗体 | 実績があり特異性も問題ない | 本当に特異性があるかは自己責任 |
| 染色条件 | 確実に染まるprotocolがある | 場合によっては自分で条件検討 |
| 発現量 | 高い | 転写因子など低い |
| 目的 | 陰性・陽性の診断 | 陰性・陽性、定量・定性など、発現差を見る事が多い |
| 手袋の目的 | 自分への感染を防ぐ | サンプルへの影響を防ぐ |
こんな感じでしょうか?
本当に重要な話で、研究者の方へ訴えたいことがあります。それは
『分子病理』のサンプルの取り扱いは、非常にデリケートだということです。
弊社には、色々な施設からパラフィンブロックが送られてきますが、染まるべき抗体でも染まらない、そんなことがよくあります。
実は、パラフィンブロックの作り方で大きな品質差(染色差)があることが判明しました。
その驚きの染色結果を下記に掲載します。
【写真の説明】杆体細胞と錐体細胞の層が染まる2種類の抗体の免疫染色
抗体:抗体A、抗体B の2種類
サンプル:マウス網膜
①病理検査室でパラフィンブロックを作製
②弊社の包埋装置CT-Pro20でパラフィンブロックを作製
※弊社で①②のサンプルを同時に同じprotocolで染めました。
結果、抗体A、抗体Bの染色特異性までが変わってしまいました。
これは病理検査室で作製したブロックの品質の問題と考えています。
【私たちが考える品質低下の原因】
病院や研究機関の包埋装置は、大量処理ができるように設計され、エタノール、キシレン、パラフィンなど、全ての溶媒を交換する時、装置によっては20Lくらいの廃液が出る、またコストも掛ることから、溶媒の使い回しする習慣がある。
またイソプロパノールなどが含まれた病理用エタノール、キシレンにも、問題があると考えています。
【問題解決方法】
免疫染色やISHでは、出来る限り溶媒を入れ替える、或いは頻繁に交換することで、安定した高品質のパラフィンがブロック出来ます。
エタノールは100%、特級グレードの物をお奨めします。
貴重なサンプルが、バラバラの低品質では、何を染めて見ているのかも分からなくなります。
尚、弊社の受託試験の場合、ISH、免疫染色グレードのパラフィンブロックを作製時は、全ての溶媒を新しく交換しています。
| 病理検査室でパラフィン包埋ブロック作製 | 弊社CT-Pro20でパラフィン包埋作製 | |
| 抗体A | 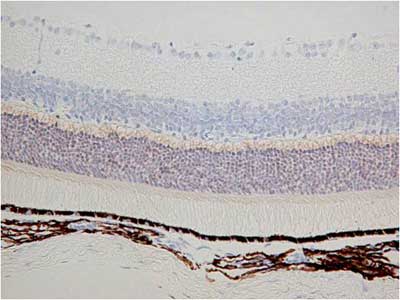 |
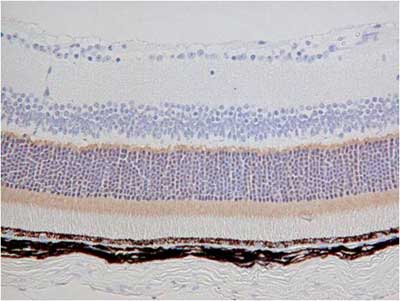 |
|---|---|---|
| 抗体B | 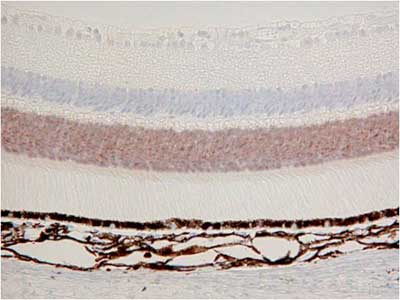 |
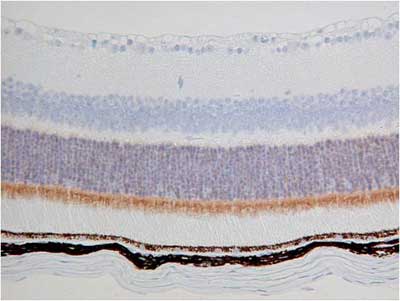 |
そこで私たちが、パラフィンブロックの品質の標準化や高感度化を目的に開発、製品化したのが『パラフィン包埋装置 CT-Pro20』です。
溶媒全てを交換しても3L程度で苦になりません。
毒性の強いキシレンも使用しておりません。
研究用の少量サンプルを取り扱うには最適です。
