2017年12月20日 更新
実験動物を用いた組織染色で、灌流固定は非常に重要なのですが、そんなの関係あるの?と意外に簡単に考えていないでしょうか!?
それも人によって方法や灌流時間も違いますし、しない方もいます。我々は、灌流固定の方法、或いはするしないで大きく染色結果に影響することを経験しています。
我々の実験で『脳、脊髄、下垂体、神経節(DRG)、肝臓、腎臓、副腎、脾臓、膵臓、舌、リンパ節、脂肪、乳腺、唾液腺、胎仔』などの組織を用いてISHやIHCを行う場合は、染色性が良くなるという結果が得られています。
それでは灌流固定の方法について話しましょう。
色々聞き回ったところ、シリンジやペリスタリックポンプを用て行う方が一般的には多いようです。手軽さでは良いのでしょうが、この方法を我々はお薦めしていません。
というのは、シリンジやポンプで灌流固定した組織を提供いただき染色した経験があるのですが、、、、その場合、非常に高い確率で染色不良があったり、同じ切片上でムラが出たりすることが多々あります。酷い場合は、染まる領域と染まらない領域があったりします。
例えば、脳などで片側が染まりが濃く、反対側は染まりが薄いなどの経験はありませんか!?これらは我々の実験結果から①灌流時間が数分と短いことで固定液が行き届いた所と届かない所で染色性に差が出てしまう。②ポンプを用いること、或いはシリンジを押す個人差などで、強制的に固定液を流して毛細血管が詰まる。などが原因かと考えています。
当社では、この染色不良(固定不良)を無くす為に、点滴法を用いた落差式で約1時間送液を行っています。
この方法で、マウス・ラット・動物によって流速(流量)と固定液の総量を決めることで全体にムラなく固定液を行き届かせることが出来ます。貴重な動物を無駄にすることがなくなり、標本の品質と再現性を向上させることにも成功しました。
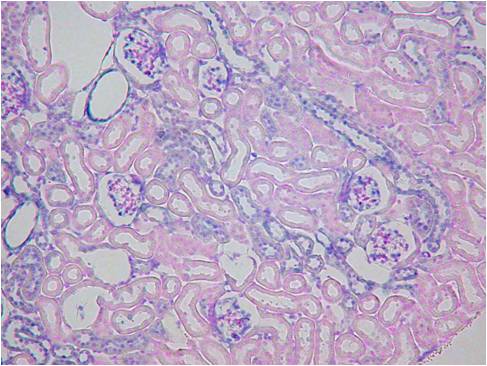
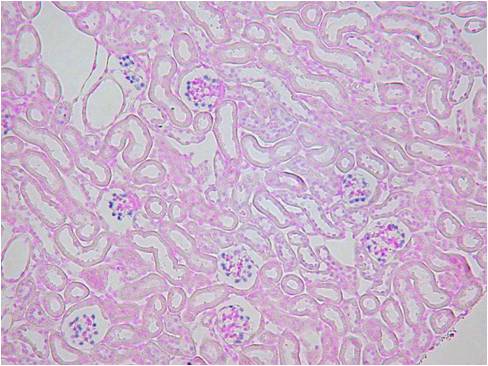
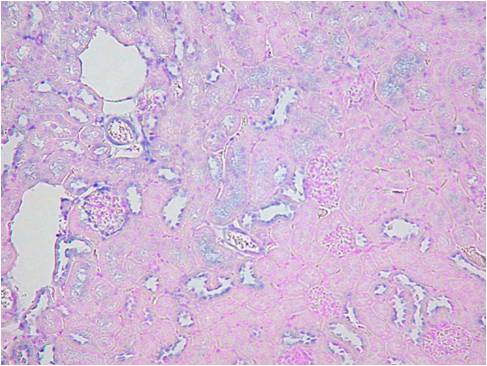
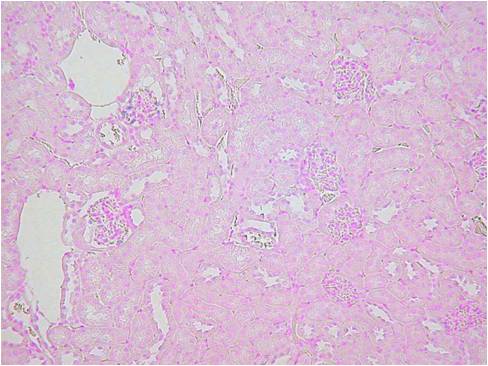
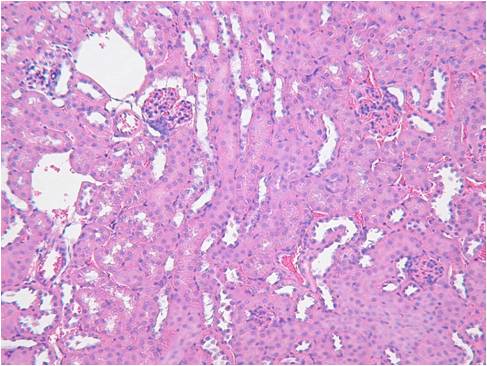
また、ISHでは灌流固定することで顕著に検出感度を上げ、シグナルを強くすことができます。下記に灌流固定した腎臓と、灌流固定しない(摘出後、直ちに固定液に浸漬)腎臓でのISHの染色比較写真を載せます。
Beta-ActinとVegfの2種類のポジコンプローブでISHを行いました。灌流固定しないマウス腎臓では非常にシグナルも弱く、染色ムラが見られました。組織の形態観察においては灌流固定しない方が綺麗でHE染色などには適していますが、分子病理的解析には灌流固定は必須ですね。
※お客様のご要望で、自社で使用していた『灌流固定ツールセット』を製品化、販売することにしました。
針先を少し丸めて左心室を突き抜けない工夫もしています。ご興味ある方は弊社までお問い合わせください。 私たちは(灌流固定)失敗しませんので・・・
固定方法によるパラフィンブロックの品質の比較
組織:マウス腎臓
遺伝子:Beta-Actin,Vegf
灌流固定あり
 |
 |
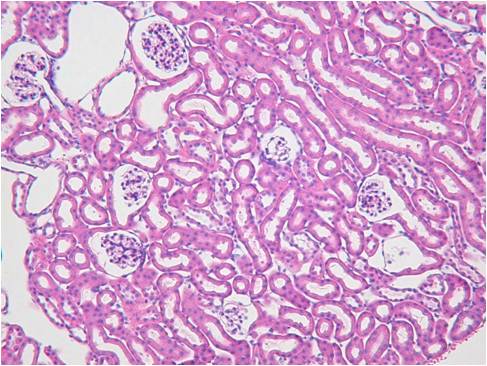 |
| Beta-Actin | Vegf | HE染色 |
灌流固定なし
 |
 |
 |
| Beta-Actin | Vegf | HE染色 |
